

ヒトの免疫機構は大きく分けると自然免疫と獲得免疫に分けられ、獲得免疫は更に液性免疫と細胞性免疫に分けられます。
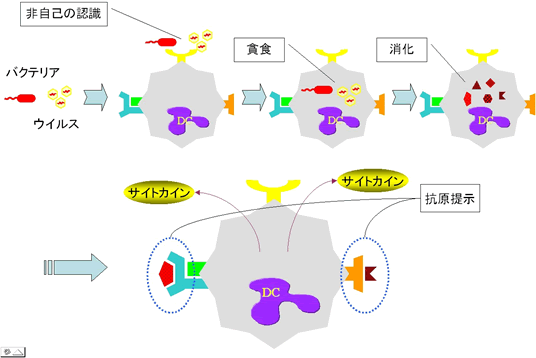
自然免疫は主に免疫応答の初動を司り、食べて消化する方法、細胞ごと殺傷する方法により非自己を排除します。
それと共に消化した非自己の一部を細胞表面に表出し(抗原提示という)、非自己の情報を獲得免疫へ伝達する、サイトカインと呼ばれる生理活性物質を放出して獲得免疫を発動する、といったことも行っています。
自然免疫より伝えられた情報を基に作動する獲得免疫は強力かつ効果的な手段により、非自己の排除を行っています。
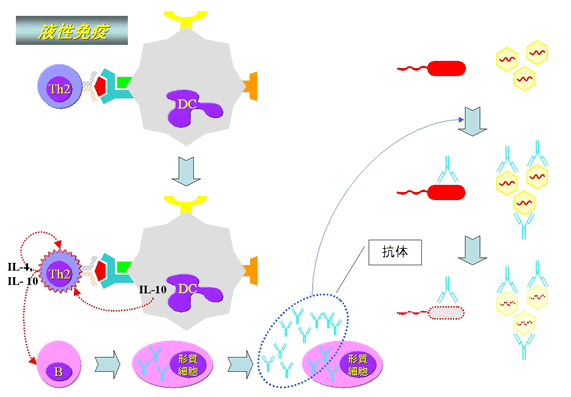
獲得免疫の細胞性免疫は細胞を殺傷することができるキラーT細胞(CTL)が最終的に働く免疫であり、液性免疫はバクテリアやウイルスに結合し、除去を促進する抗体が作用する免疫です。

尚、種々の細胞間のコミュニケーションは前出のサイトカインと呼ばれる物質や直接的な接触によりなされています。
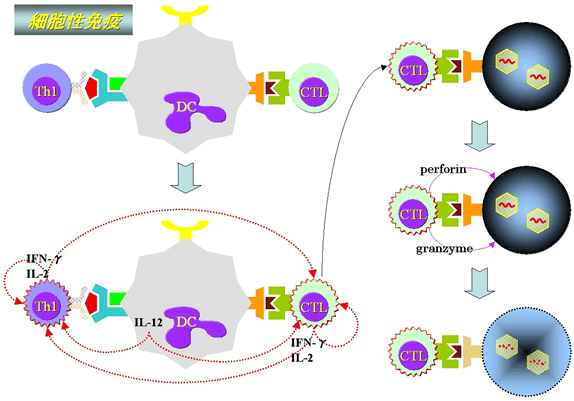
例えば、細胞性免疫では非自己をキャッチした樹状細胞(DC)により抗原提示が行われると共にインターロイキン-12(IL-12)が放出され、IL-12がTh1の増加・活性化(機能亢進状態)を促し、活性化されたTh1からIL-2、インターフェロン-ガンマ(IFN-γ)が放出されNK細胞やNKT細胞、CTLが活性化される、といった具合です。
ヒトの体の中で腫瘍細胞は細胞分裂の速度や分裂時の遺伝子エラーの頻度などから、毎日6,000個程度できていると想定されています。
その殆どが疾患としての癌を形成しないが、これは癌抑制遺伝子の働きや免疫の作用によるところが大きいと考えられます。
前者については別項に譲るとして、後者の作用機序は以下のようなことが考えられています。
まず、免疫機構による腫瘍細胞の排除は細胞性免疫が担うが、その時には腫瘍細胞が免疫担当細胞からみて排除対象(標的)となる必要があります。
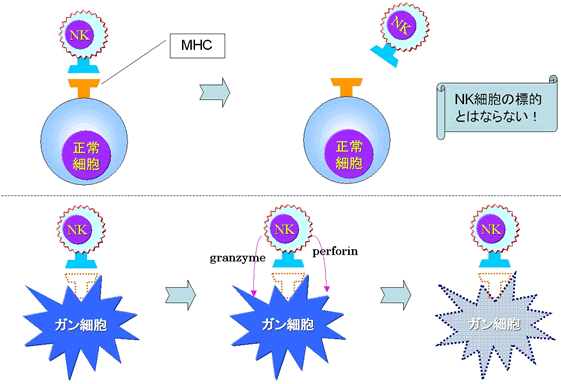
標的となるには二つのケースがあり、一つは自己の目印となる主要組織適合抗原(MHC)の発現が無い場合で、もう一つは非自己と識別される腫瘍抗原を発現している場合であります。
MHCの発現が無い場合はナチュラルキラー細胞(NK細胞)の標的となり、NK細胞による殺傷が必然的に誘発されます。このような腫瘍細胞は体の中で出来た先からNK細胞により破壊されていきます。
尚、この破壊はperforinやgranzymeなどの細胞障害性蛋白などにより行われています。
また、腫瘍抗原を発現している場合には、まず、腫瘍抗原(非自己)の貪食、抗原提示能を持つDCやマクロファージ(Mφ)にその抗原ごとキャッチされ、非自己と認知したDCやMφは貪食、抗原提示を行うと共にIL-12などのサイトカインを分泌し、提示した腫瘍抗原に対応する受容体を持ち合わせたCTLの増殖・活性化(機能亢進状態)を促します。
更にIL-12はTh0へ作用し、Th1への分化を誘導すると共に増殖・活性化をも促し、この活性化されたTh1から産生されるIL-2やIFNーγがCTLの活性を更に高めます。
十分に機能亢進状態となった活性化CTLが腫瘍抗原を目印としてその目印を持った細胞を特異的に狙い、無くなるまで殺傷し尽くします。
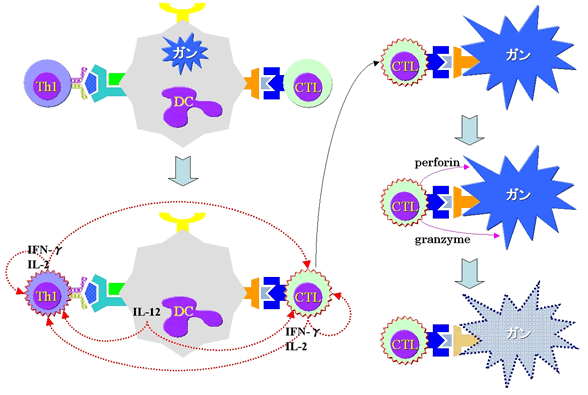
更に、DCやMφによる抗原提示を介さずとも腫瘍抗原に対応する受容体を持ったCTLがIL-12やIL-2刺激により活性化し、直接腫瘍細胞を殺傷することも想定されます。
尚、CTLが認識する腫瘍抗原は10個程度のアミノ酸か連なったペプチドと呼ばれるもので、蛋白質が小さく分解されたものです。
腫瘍抗原にはこのペプチド以外にも糖鎖抗原に分類されるものや糖脂質に分類されるものがあり、糖脂質を腫瘍の目印として認識し、腫瘍細胞の殺傷を行う細胞にNKT細胞と呼ばれる細胞があります。
この細胞はCTLには見つけることが出来ない目印を見つけて腫瘍細胞の排除を行っているため、NK細胞やCTLと協同あるいは単独で腫瘍の排除を行っています。
これらの作用により、体の中での腫瘍細胞の生存を阻止し、疾患としての癌の発症を抑制しているのです。
疾患としての癌が成立するには腫瘍細胞には免疫からの攻撃を回避する力が不可欠となります。
この能力にはMHCの発現やNK細胞の活性を抑制する受容体の発現によるNK細胞からの攻撃回避、NKT細胞やCTLの目印となる腫瘍抗原の欠失、あるいはそれらの細胞の攻撃を回避する様々な受容体の発現や逆に免疫細胞を障害する受容体の発現、免疫細胞の活性を低下させるTransforming Growth Factor-β(TGF-β)などのサイトカインの産生等々、種々の機構が存在します。
これらの機構により、免疫機構からのエスケープが成立した腫瘍細胞はその後無秩序に増殖することとなります。
また、正常細胞も腫瘍細胞も区別なく、細胞が生存するためには酸素や栄養の補給が不可欠となり、これは血液により供給されています。
腫瘍の増殖とは腫瘍細胞の数が増えることであり、この時には増加した細胞の分だけ余計に酸素や栄養の補給が必要となります。
腫瘍細胞はこの問題を血管内皮増殖因子(VEGF)や繊維芽細胞増殖因子(FGF)などの増殖因子を産生することにより解決しています。
これらは血管そのものを作ることができる増殖因子であり、それにより新たな専用の血管を生成し(血管新生)、酸素や栄養の確保を行っています。
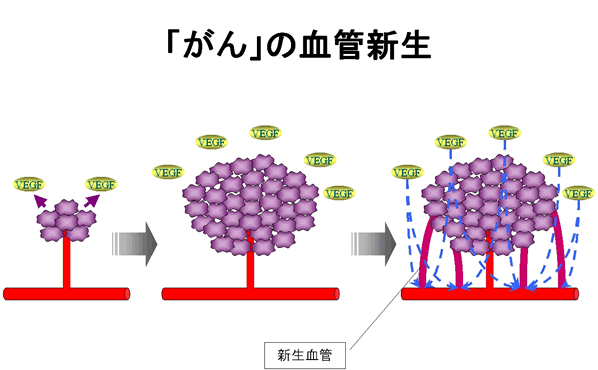
以上のような機序により、腫瘍細胞は宿主を滅ぼすまで無秩序に増殖することが出来るのです。
新免疫療法(NITC)は腫瘍の増勢を抑制し得る「血管新生の抑制」と腫瘍量を減らし得る免疫能の強化を柱としており、腫瘍を縮小させるまたは腫瘍の増大を抑制することを狙った治療法であります。
具体的には免疫能を高める目的で複数のβ-Dグルカンを含む医薬品や食品を用い、血管新生を抑制する目的でサメ軟骨の加工品を用いています。
免疫能を上げ抗腫瘍効果を来たすには、最終的に腫瘍細胞を障害するNK細胞、NKT細胞、CTL(以下まとめてeffector細胞という)の恒常的な活性化つまり細胞性免疫の亢進が必要となります。
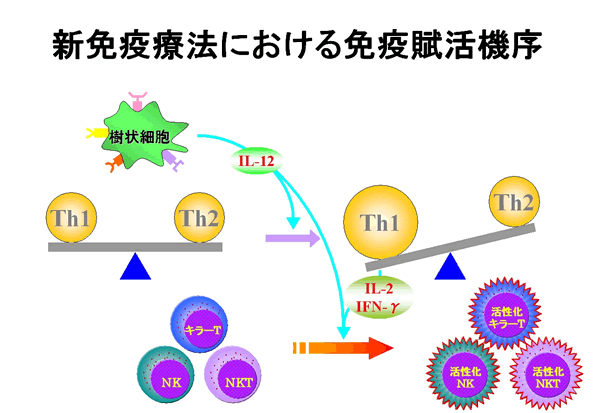
前述の如く、細胞性免疫はDCやMφから産生されるIL-12を端緒にTh1の分化・増殖・活性化を経てeffector細胞の活性化へと繋がります。
そこで新免疫療法(NITC)は、そのeffector細胞の活性化を導く引き金となるIL-12の産生能の増強を図ることにより、細胞性免疫の亢進を成し遂げようとするものです。
IL-12にはeffector細胞を活性化する作用があることは広く認知されており、実際に米国では工業的に生産されたリコンビナントIL-12(rIL-12)を薬剤として利用しようと研究されていたこともあります。
もっとも、この試験は動物実験では強い抗腫瘍効果が認められ大きな期待が寄せられたものの、ヒトの臨床試験では副作用の問題が大きかったため、途中で中止となり、薬剤としての応用は頓挫しています。
これは一過性に高濃度のrIL-12を投与することに問題があり、新免疫療法(NITC)ではこのような状態とならないように体の恒常性の範囲内で作られる内因性IL-12を増強することを主眼としており、この点が重要となります。
体に備わった恒常性維持機構により、悪影響がでない範囲で最大限のIL-12の産生を誘導することが肝要なのです。
次にIL-12の産生を上げる機序でありますが、ここにβ-Dグルカンが関与しています。
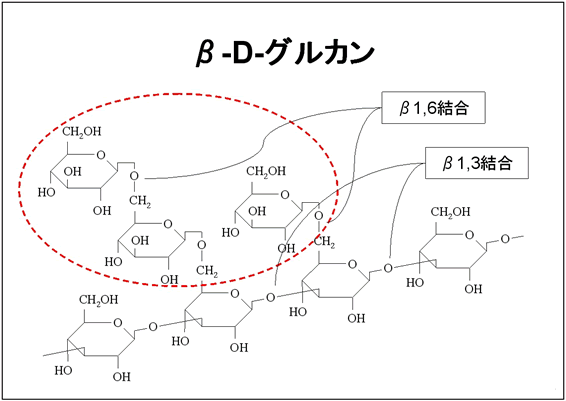
β-Dグルカンはバクテリアなどの細胞壁を構成する成分で、バクテリアの他、キノコや酵母、海草などに含まれているD-グルコースがβ1,3あるいはβ1,6結合により多数つながった多糖体です。
また、IL-12は主にDCやMφなどの自然免疫に関与する細胞で産生され、その契機は非自己の認識により誘発されます。
DCやMφは非自己を認識する場合に種々の受容体を使っていますが、その中でDectin-1と呼ばれる受容体がβ-D-グルカンと結合することが分かっており、その結合を契機に免疫応答が引き起こされることとなります。
したがって、β-Dグルカンを含有する薬剤の服用や食品の摂取によってDectin-1を介したDCやMφからのIL-12の産生を促すこととなります。
通常、非自己を認知し、排除するまでの一連の生体反応である免疫応答は体内で二次リンパ器官と呼ばれる脾臓や扁桃、リンパ節などで起こりますが、中でも腸に形成されているパイエル板が最も大きな免疫応答の場のひとつとなります。
β-Dグルカンはβ結合をしたDグルコースの重合体であり、ヒトはβ結合を切断する酵素を持っていないため、経口摂取されたβ-Dグルカンは殆ど消化されずに腸のパイエル板に到達し、そこで前述の免疫応答を引き起こすこととなります。
さらに摂取された一部と注射薬にて投薬したβ-Dグルカンは血中に吸収されリンパ節などのパイエル板以外の二次リンパ器官にて同様の免疫応答を引き起こします。
このような作用機序により、新免疫療法(NITC)ではIL-12の産生誘導からeffector細胞の活性化を経て腫瘍細胞の殺傷を導き、結果として腫瘍の縮小または増大の抑制を来たすのです。
また、β-Dグルカンはβ1,3結合を主鎖として連なった構造をしていますが、β1,6結合による側鎖が分岐しています。
この側鎖の長さや位置はβ-Dグルカンを含む物により異なると考えられており、これが免疫応答の誘導能の差異となっていると推察されます。
更に、IL-12の産生誘導能で見た場合、早期に誘導するが短期間で産生しなくなるものと、それより遅く誘導するが長期産生が持続するものがあることが実験で確かめられており、その原因もこの側鎖構造の差異によるものと考えられます。
新免疫療法(NITC)ではこの2種類を併せて摂取することにより、早期かつ持続的なIL-12産生能の誘導を行う設計となっています。
血管新生の抑制は腫瘍への酸素や栄養供給路を断ち、それ以上の増大を防ぐこととなります。
また、腫瘍が作る新生血管は正常血管の内膜・中膜・外膜の三層構造とは異なり、内膜だけの一層構造となっているため、血中の液体が染み出易く、それが胸水・腹水を引き起こすことから、その抑制はこのような臨床症状の緩和にも結びつくと考えられます。
新免疫療法(NITC)では血管新生の抑制を目的として、サメ軟骨の加工品を用いています。
この選定にはマウスを用いた血管新生の実験系であるドルザール・エアザック法にて検索を行っており、また、油脂にてコーティングすることにより、熱や酸に弱い、生臭いといった欠点を補っています。
現在、多くのサメ軟骨加工品が市販されているものの、その大半がこの欠点を克服していないため、効果が低いと予測されますが、新免疫療法(NITC)で用いているサメ軟骨加工品はそれらのものとは一線を画しています。
サメ軟骨による新生血管の阻害作用は実験系から確認されたことであり、その作用機序については不明な点が多いのですが、ムコ多糖が作用していると考えられます。
研究のEvidence levelは高くはないのですが有効例では無効例に比し、VEGFの血中濃度が有意に低いといった知見も得られており、このことから、ムコ多糖によるVEGFなどの血管を作る増殖因子の抑制による機序が想定されます。
また、サメには硬い骨が無く、全て軟骨で形成されており、軟骨には血管が無いことからも血管形成を抑制する物質があることが間接的にではあるが予測されます。
新免疫療法(NITC)では定期的に実施する超音波検査などの画像診断や血液検査により、治療効果を評価し、適宜治療法の変更や薬剤、食品の増減、変更を行っています。
超音波検査では主病変及び頸部から下腹部まで網羅的に検索し、胸腔内や腹腔内の実質臓器(肝臓など)への転移及びリンパ節転移、また、必要に応じて全身の皮膚に近い位置の病変などをチェックし、腫瘍の大きさや血液の流れ方による改善・増悪の判定を行います。
それから、血液検査では、腫瘍マーカーによる腫瘍の動態及び免疫能の評価を行っています。
腫瘍マーカーは偽陰性や偽陽性を呈することがあるため、異常値を示すもの全てでモニタリングし、偽陰性などの問題を極力回避して評価しています。
また、免疫能ではIL-12やIFN-γなどのサイトカイン産生能、Th1とTh2の比、及びNK細胞、NKT細胞、CTLの活性化状態などを指標としています。
これらの測定には酵素免疫測定法(ELISA法)やフローサイトメトリー法(FCM法)等の技術が用いられておりますが、これらの手法による評価方法は必ずしも完成されたものではなく、今後の免疫学や分子生物学の発展に伴い更なる改良が施されるものです。
免疫の力は、白血病などの治療目的で行われる同種骨髄移植に伴う移植片対宿主病(GVHD:移植された提供者の免疫細胞が患者の様々な臓器を障害する病気)などでも分かるように、時としてヒトの命を奪ってしまうほど強力なものです。
ところが、このような強力な働きをもってしても太刀打ちできない癌は実に様々な生存競争を勝ち抜く機構を備えているものと予測されます。
そのため、治療を施しeffector細胞を活性化できたとしても結果が伴わないケースがあることも想定され得ます。
このような機構の解明は今後の治療効果の向上のためには無くてはならないものであるのですが、残念ながら昨今の癌治療は腫瘍細胞の殺傷にしか目が向けられていない状況です。
確かに腫瘍幹細胞などの腫瘍発生学的な研究や増殖シグナルに関与する増殖因子やアダプター因子の究明、正常から逸脱した遺伝子発現機構の解明は分子標的薬などの従来の抗癌剤とは異なる腫瘍特異性が高い薬剤の開発に有用であり、今後更なる発展が必要です。
しかし1個の腫瘍細胞が1cm程度の腫瘍塊に成長すると個々の細胞レベルでは既に遺伝子の不均一性が認められます。
このことは僅かな分裂・増殖の間にも新たな遺伝子変異を獲得でき得ることを証明するものであり、そのため、どのような作用機序の薬剤であったとしても無効となる可能性があることは容易に想定され、限界があるといわざるを得ません。
このような一方からのアプローチでは癌という病気を克服することは困難であり、やはり、宿主の防御機構である免疫からのアプローチも併せて行う必要があると考えます。
地球上で35億年以上前に最初に誕生した生物はその後様々な生存競争を勝ち抜くべく進化を遂げ発展してきました。
現在、その頂点に君臨するのはヒトであり、そこには生存を勝ち取るための進化が凝縮されているのです。
その偉大な力を損なうことなく、それを助長し、現在の先端医療と協調して病を克服することが必要なことであると信じて止みません。
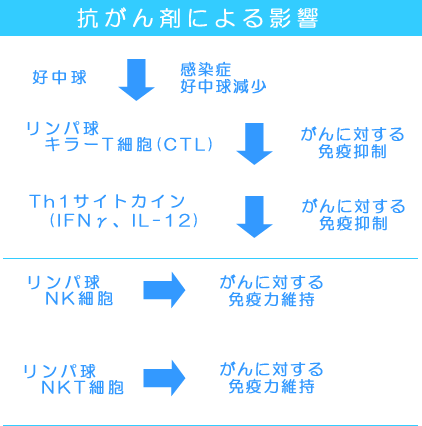
殆どの通常量の抗がん剤は、白血球中の好中球(数や貪食能力および殺菌力)を低下させます。
従って、扁桃腺炎、肺炎、虫垂炎などの感染症を起こしやすくなります。危篤になれば、敗血症を起こし、死亡することもあります。
癌に対する細胞性免疫力では、好中球が関与することは少ないと考えられており、細胞性リンパ球が主力となります。
細胞性リンパ球にはT細胞、B細胞、NK細胞、NKT細胞の4種類があります。この内、B細胞は免疫抑制(細胞性免疫低下)に働きます。
抗がん剤は、細胞性免疫の主力のT細胞、NK細胞、NKT細胞などを抑制しますが、その抑制する力には差があります。
通常量の抗がん剤投与で、NK細胞とNKT細胞は殆ど抑制されません。
一方、T細胞やT細胞の数や活性は、通常量の抗がん剤で抑制されます。
最近、通常量の抗がん剤の投与でも殆ど細胞性免疫を抑制しない抗がん剤がごく稀にあることが発見されました。
その一つがジェムザールであり、二つ目がオキザリプラチンであります。
ジェムザールは現時点では膵臓癌と肺癌、胆道癌に保険が適応されていますが、T細胞、Th1サイトカイン(TNFγ、IFNγ、IL-12)を抑制しないことを初めて発見しました。
また、オキサリプラチンは結腸・直腸癌に保険薬として2005年に認可されましたが、この薬剤も同様であることが分かりました。
注意しなければならないのは、このジェムザールやオキサリプラチンは何れも好中球の低下は比較的強いことです。
通常量の抗がん剤はT細胞、Th1サイトカインの産生を抑制します。
しかし、これらの抗がん剤も低用量and/or分割投与で投与するとあまり免疫を抑制しないことが分かりつつあります。
個々人の免疫能力や、抗がん剤の種類によりその毒性に差がありますが、例えばタキソールの場合、60mgで週1回を3週連続、1週間休みで開始し、副作用・効果を見ながら投与量・投与間隔を増減します。
この投与法ですと消化器症状、血液異常、脱毛などの副作用は殆んど出現せず、Th1サイトカイン(IL-12やIFNγ)の産生に影響しにくいと考えております。
また、β1-3グルカンはT細胞やTh1サイトカインの抗がん剤による抑制をやわらげてくれることが分かっています。
消化管粘膜の炎症や潰瘍を治す力を持っている上皮細胞成長因子(Epidermal Growth factor: EGF)が、唾液の中に沢山含まれています。
このEGFが上皮細胞の表面上にある上皮細胞成長因子受容体(EGFR)に接着することで、「細胞増殖、成長や血管新生、そして、アポトーシス(細胞死)を阻害する遺伝子情報」などの情報が核に伝達されます。
この様に細胞の分裂が促進する時に、細胞内エネルギーのATPが受容体型チロシンキナーゼに受け渡されることで、活性化が起こります。
このEGFRは正常細胞では数個ですが、癌細胞は沢山持っています。また悪性度の高い癌細胞ほど多いことが知られています。
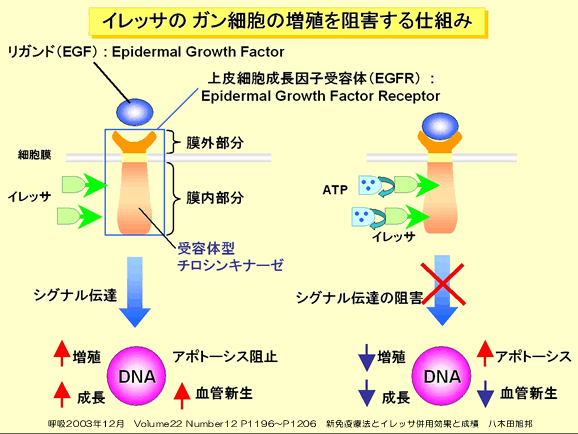
では、イレッサは癌細胞のどこに働くのでしょうか。
前述のように、EGFが細胞表面のEGFRに接着した時に、細胞内エネルギーATPは受容体型チロシンキナーゼに入ろうとするのですが、その前にイレッサが入ってしまうため次に入ることは阻害されてしまいます。
核はATPのエネルギー伝達が入らないので、核分裂を起こすことができなくなります。その結果癌細胞の増殖が止まってしまうことになります。
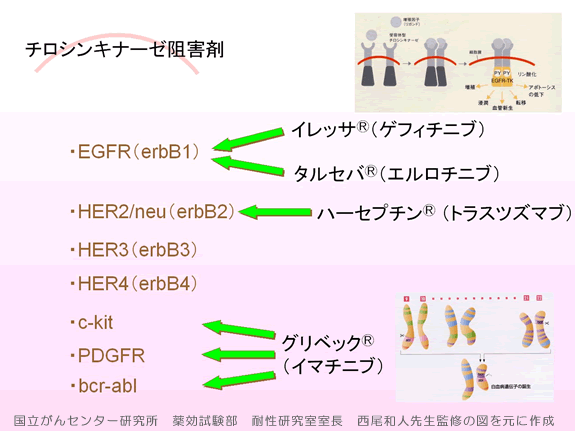
このチロシンキナーゼには、現在まで、5種類が見つかっています。
それらは、EGFR(erbB1)、HER2(erbB2)、HER3(erbB3)、HER4(erbB4)であり、そして、PDGFRやPDGFファミリーのc-kitがあります。
現在、EGFR阻害薬は非小細胞肺癌、HER2阻害薬は乳がん、そして、PDGFが慢性骨髄性白血病や平滑筋肉種に、それぞれ保険が適応となっています。
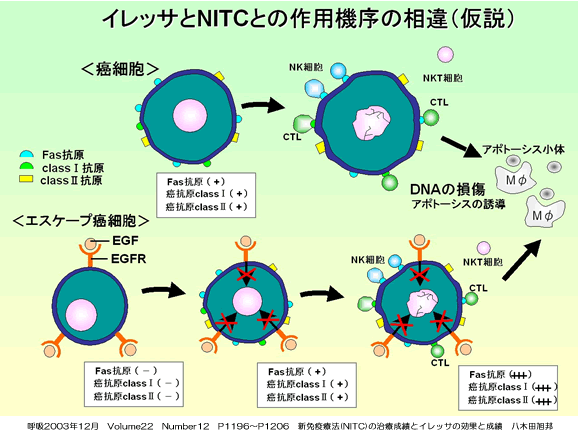
一方、癌抗原を表出していない悪性度の高い癌細胞は攻撃の目印ありません。このため免疫細胞は攻撃ができません。
このような悪性度の高い癌細胞はEGFRをより沢山持っており、どんどん細胞分裂を起こし増殖していると考えられます。
しかし、イレッサを投与しますと、EGFRの遺伝子情報がストップして増殖がストップすると同時に癌細胞の表面に癌抗原を表出することが分かっています(この点については、我々はヒト癌細胞で証明しつつあります)。
そうしますと、今まで目印がなかったため攻撃できなかった免疫細胞の攻撃が可能になります。
このようにイレッサと新免疫療法(NITC)との併用は、イレッサにより癌抗原が表出され、かつ新免疫療法(NITC)でエフェクター細胞(CTL、NK、NKT細胞)が活性化されるので、癌細胞を攻撃しアポトーシスに導くことが容易になります。
以上のことより、イレッサと新免疫療法(NITC)との併用は、相乗効果が認められると考えられます。
オリエント腫瘍免疫研究グループ代表
医学博士 八木田旭邦


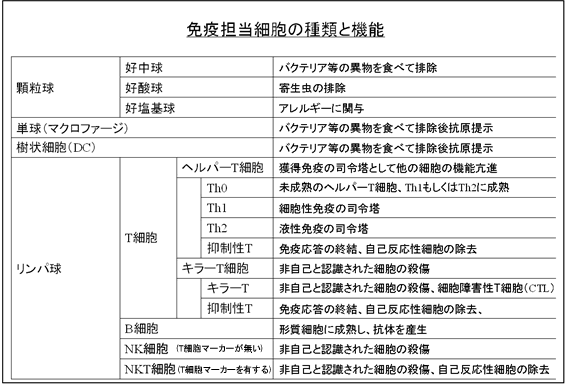
免疫はヒトの体に備わった病気から免れる働きであり、種々の免疫担当細胞達の協同により成り立つ仕組みであります。
空気中、土中、水中には様々なバクテリア、ウイルス等が存在しており、その中にはいわゆる病原性を持ったものも多数含まれます。
よって、ヒトは常に感染の危機に晒されているといっても過言ではないのです。これらの感染から回避・防御が種の保存に必須であり、生物の進化と共に免疫機能も進化を遂げてきたのです。
免疫機構は簡潔に言うと自分を構成する物質(自己)とそれ以外(非自己)を識別し、非自己を認知、選択的に排除することで病気を予防・治癒せしめる働きであります。
排除の方法としては食べて(貪食)消化し取り除く方法や抗体と呼ばれる蛋白質を使う方法、非自己がウイルス感染細胞のような場合には細胞ごと殺傷するといった方法があります。
これらの働きは免疫担当細胞達の連携により効率的かつ効果的に行われる仕組みとなっています。